我院杨玉春助理教授在厌氧氨氧化 (Anammox) 菌的研究中取得新进展
我院杨玉春助理教授近日与广东以色列理工学院、深圳大学、杜伊斯堡大学、维也纳大学和香港大学的课题组合作在水生态环境领域顶级期刊Water Research(IF:13.4)发表题为Discovery of a new genus of anaerobic ammonium oxidizing bacteria with a mechanism for oxygen tolerance的研究论文(全文链接:https://www.sciencedirect.com/science/article/pii/S0043135422011101),我院杨玉春助理教授和深圳大学卢中一博士为共同第一作者,广东以色列理工学院顾继东教授为通讯作者。
本文的图片摘要
1995年Mulder等人首次发现了厌氧氨氧化(anaerobic ammonium oxidation,Anammox)过程,厌氧氨氧化菌在厌氧的条件下直接将NO2-和NH4+转化为N2,Anammox的发现极大地改变了人们对于地球无机氮循环的认识。Anammox参与脱氮具有无需添加外源有机碳源、容积负荷高、运行费用低、温室气体排放少等优点,Anammox一经发现便被广泛应用于污水处理,到目前全世界范围内已经有100多个污水处理厂应用Anammox脱氮。在分类上,厌氧氨氧化菌属于浮霉菌门(Planctomycetes),但是它们在进化上独立于其他浮霉菌,因而能在进化树上形成一个独立分支。截至目前,已经有Ca. Scalindua, Ca. Kuenenia, Ca. Brocadia, Ca. Anammoxoglobus, 和 Ca. Jettenia总共5个属的厌氧氨氧化菌被发现和命名。除了Ca. Scalindua首先在海洋中发现以外,其他4个属均在生物反应器/污水处理厂中首先被发现。但是,在2008年第5个属Ca. Jettenia被复旦大学全哲学教授发现并命名之后,在过去的十几年里没有新的厌氧氨氧化菌属被发现和报道,这极大地限制了我们对于厌氧氨氧化菌的深入认识。
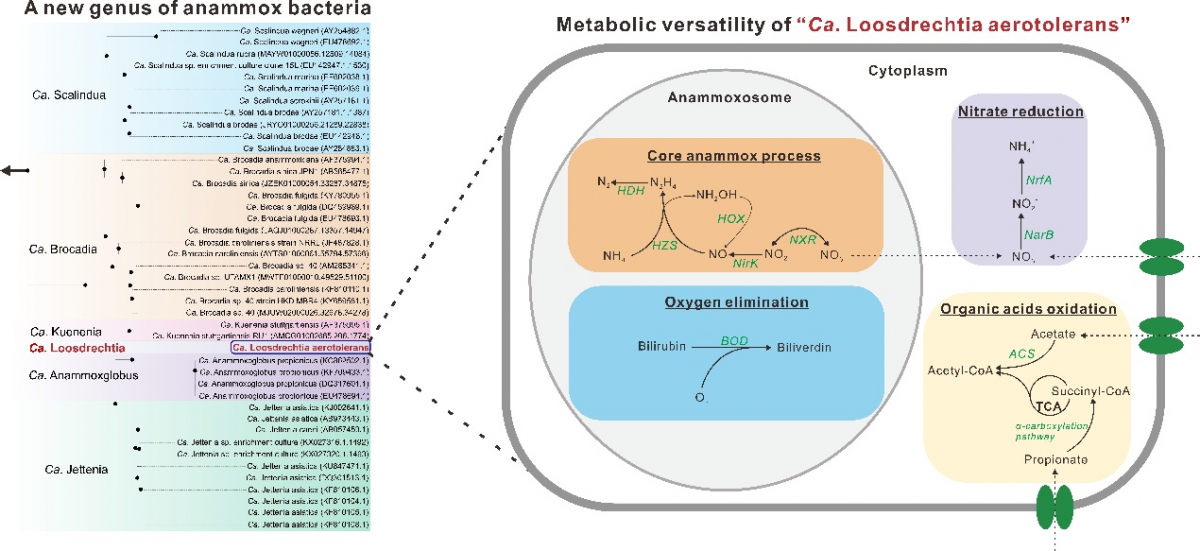
基于此,本项目采用宏基因组和宏转录组相结合的方法,深入分析了德国ZDE污水处理厂中厌氧的生物膜体系中微生物的群落组成和代谢潜能。我们惊奇地发现,4种完全不同的厌氧氨氧化菌共同生活在同一个生物膜体系中,其中包括一个非常新的厌氧氨氧化菌基因组。进一步通过分析这个新的厌氧氨氧化菌与已知厌氧氨氧化菌的16S rRNA基因的进化关系和相似性,发现这个新型的厌氧氨氧化菌并不属于已知的5个属,而是代表了一个新的厌氧氨氧化菌属,因此我们将其命名为:“Candidatus Loosdrechtia aerotolerans YC1”(图1)。其中属名Loosdrechtia是用Mark van Loosdrecht教授的名字命名的。

图1 (a) “Ca. Loosdrechtia aerotolerans” (红色字体) 和其他已知厌氧氨氧化菌 (黑色字体)基于 16S rRNA 基因的进化分析。 (b) 热图展示了 “Ca. Loosdrechtia aerotolerans”和其他已知厌氧氨氧化菌16S rRNA基因相似性。
进一步通过详细的基因组和转录组学分析,构建了“Ca. Loosdrechtia aerotolerans”的核心代谢通路(图2)。发现其基因组编码了完整的Anammox代谢途径,并且几乎所有的核心基因均高效表达,说明其以较高的活性参与污水脱氮。除此之外,其基因组中还编码了铁氧化还原蛋白依赖型的硝酸盐还原酶(NarB),而编码NarB的基因尚未在其他厌氧氨氧化菌基因组中发现(图3)。NarB在很多微生物中被发现,被认为是参与硝酸盐同化吸收的关键酶。前期研究也已证明,厌氧氨氧化菌能通过氧化小分子有机物(甲酸盐、乙酸盐、丙酸盐)促进细胞生长。因此,NarB的存在可使“Ca. Loosdrechtia aerotolerans” 有能力利用环境中的硝酸盐为电子受体氧化小分子有机物,使其在富含硝酸盐的环境中获得竞争优势。另外,我们首次在厌氧氨氧化菌基因组中构建起完整的氧化丙酸盐的代谢途径(α-carboxylation过程),从基因组层面证明了厌氧氨氧化菌氧化丙酸盐的代谢潜能(图2)。
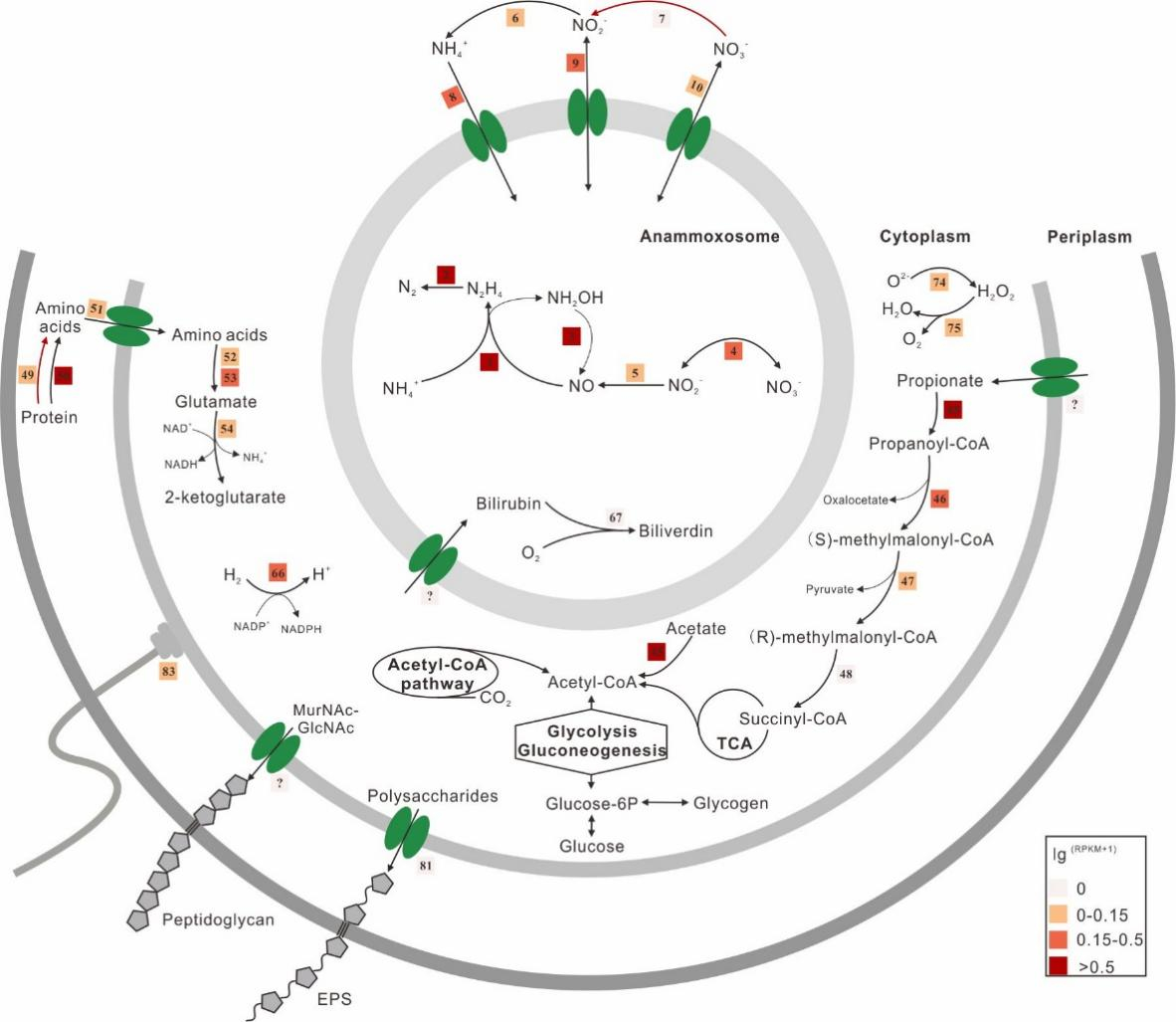
图2 通过基因组注释和转录组分析构建的“Ca. Loosdrechtia aerotolerans”细胞代谢的卡通图。
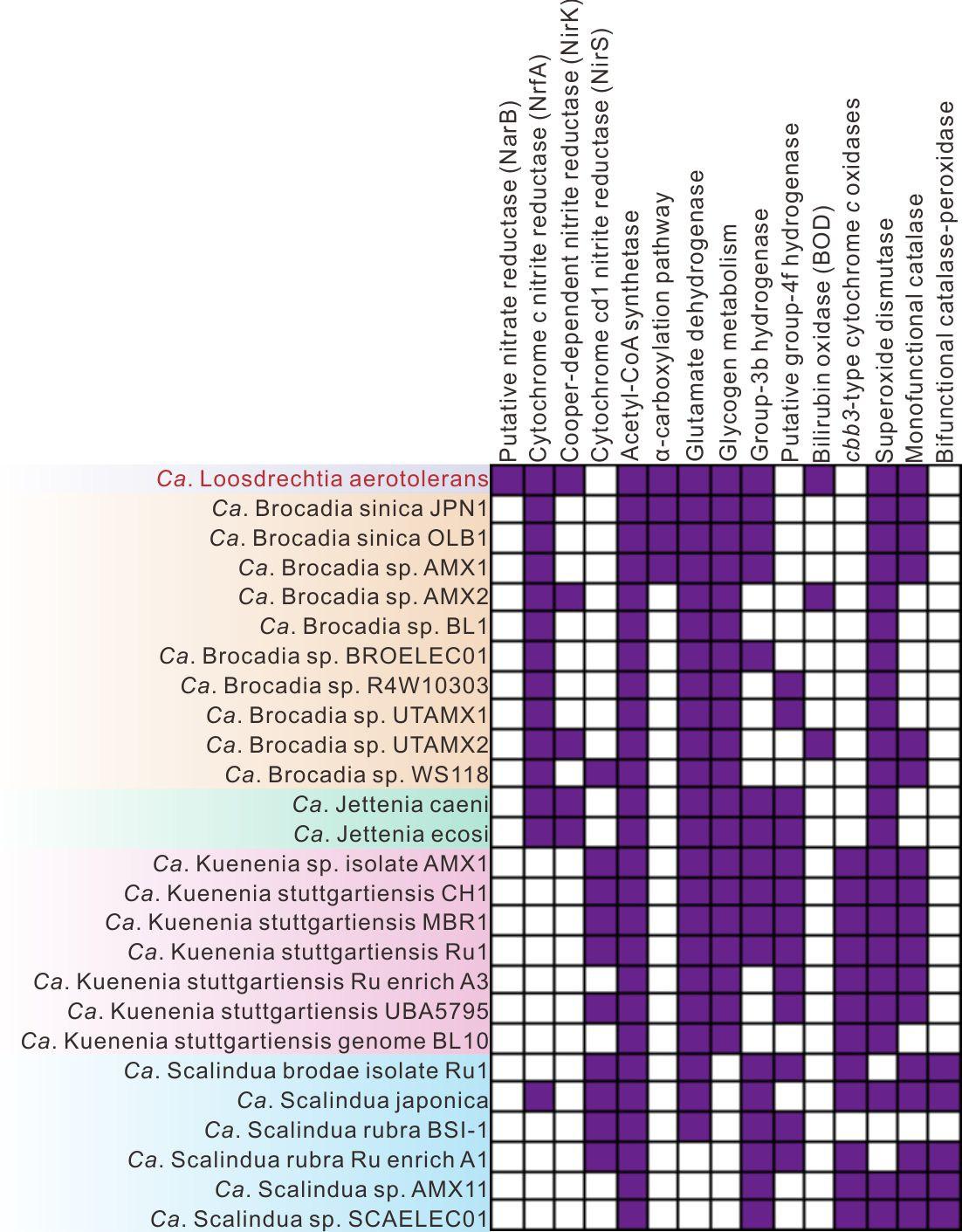
图3通过比较基因组分析构建起核心代谢相关基因在“Ca. Loosdrechtia aerotolerans” 和25 个已知厌氧氨氧化菌基因组的分布情况。
在实际的污水处理过程中人们发现,厌氧氨氧化菌并非严格厌氧,反而它们能够耐受一定浓度的氧气,但是其氧气耐受机制尚未被清楚地阐明。通过基因组分析我们发现,“Ca. Loosdrechtia aerotolerans”和另外4个Ca. Brocadia基因组中编码了胆红素氧化酶(BOD),它是一种多铜氧化酶(图4a-d)。我们进一步利用基因的异源表达和蛋白质分离纯化手段证明了厌氧氨氧化菌基因组中编码的BOD具有利用氧气氧化胆红素的能力(图4e-f)。另外,我们发现,BOD编码基因的N端含有信号肽序列(图4a),证明在细胞质中合成的BOD蛋白会通过跨膜转运来发挥其生理功能。前期研究已经证明,参与Anammox代谢的酶主要分布在Anammoxosome中,因此我们推测BOD可能被跨膜转运至由生物膜包裹的Anammoxosome中,并通过氧化有机物参与清除从周围环境中扩散进入的氧气,减少氧气对Anammox关键酶活性的抑制,提高厌氧氨氧化菌对氧气的耐受力。除此之外,通过比较基因组我们发现,绝大多数Ca. Kuenenia 和Ca. Scalindua 基因组编码了cbb3-细胞色素c氧化酶(图3)。这种酶具有较高的氧气亲和力,一般存在于好氧微生物中参与有氧呼吸。我们推测,厌氧氨氧化菌无法像好氧菌那样利用编码的cbb3-细胞色素c氧化酶进行有氧呼吸,极有可能是利用其清除细胞中的氧气,从而提高氧气耐受力。
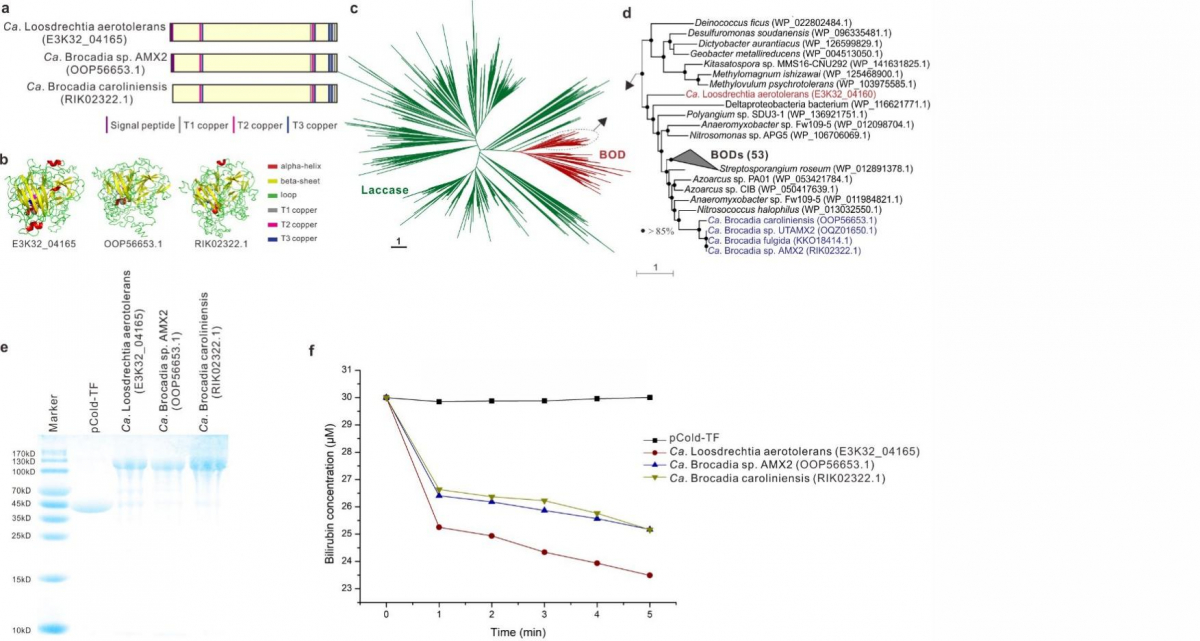
图4 (a) 3个从厌氧氨氧化菌基因组中发现的血红素氧化酶 (BODs)氨基酸序列的比对。(b) 通过软件预测的3个血红素氧化酶的三维结构。(c) 进化树分析从厌氧氨氧化菌基因组中发现的血红素氧化酶与已知多铜氧化酶(包括血红素氧化酶和漆酶)之间的亲缘关系。(d) 放大进化树中厌氧氨氧化菌基因组中发现的血红素氧化酶所在的进化树分支。(e) SDS-PAGE显示通过异源表达和单边分离纯化后得到的BOD蛋白条带。(f) 分离纯化的BOD氧化血红素的活性。
本研究在污水处理体系的生物膜中发了一个新的厌氧氨氧化菌属,并对其代谢和环境适应机制进行了深入分析,此研究结果极大地促进了我们对厌氧氨氧化菌多样性、生理代谢机制及环境适应机制的认识。下一步的工作重点应该是富集培养不同生态系统中的新型厌氧氨氧化菌,并深入研究其生理与代谢机制,相关研究将会为Anammox过程在污水脱氮中的应用提供重要参考和理论指导。



